Саркома Юинга
Саркома Юинга составляет 25,8% первичных злокачественных опухолей скелета. Болеют лица 10-25 лет, преимущественно мужс- кого пола; отмечены единичные случаи новообразования у пожилых. Опухоль может поражать любую кость, однако основная локализация - длинные трубчатые кости конечностей (обычно в области диафиза) и кости таза.
Этиология и предрасполагающие факторы неизвестны.
Как и при других костных саркомах первым признаком заболевания обычно бывают тупые, тянущие боли перемежающегося характера. Постепенно боли усиливаются и становятся постоянными. В области болей можно пропальпировать плотную, неподвижную, без чётких границ опухоль. В большинстве случаев выявляют характерную клиническую картину: слабость, недомогание, высокую температуру тела (до 39-40 С), лейкоцитоз, увеличение скорости оседания эритроцитов (СОЭ). При осмотре обнаруживают гиперемию и гипертермию кожи над опухолью, расширение подкожных вен. Заболевание носит циклических характер: выраженность клинических проявлений может значительно уменьшаться, а затем вновь нарастать.
Метастазы выявляются рано. Диссеминация у большинства больных происходит в течение первого года заболевания. Важной биологической особенностью саркомы Юинга считают её способность давать метастазы в лимфатические узлы (в 20% случаев) и другие отделы скелета (особенно в кости черепа и позвоночник). Метастазы в костях обнаруживают, в среднем, через 8-9 мес от начала лечения. Частота выявления метастазов в лёгких составляет 45-65%; они появляются позднее, чем метастазы в костях. На поздних стадиях происходит метастазирование в печень, почки, головной мозг и сердце. Среднее время появления всех метастазов - 11,2 мес.
Микроскопически опухоль состоит из мономорфных клеток с округлыми или овальными ядрами и узким ободком светлой цитоплазмы без чётких границ. На фоне почти сплошного клеточного поля видны полости различных размеров и формы, заполненные кровью. Стромальные волокнистые элементы в опухоли почти отсутствуют.
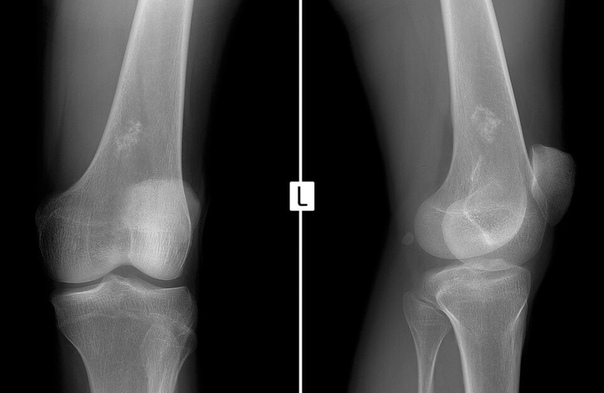
Рентгенологические проявления полиморфны и в значительной степени зависят от локализации опухоли в различных отделах ске- лета.
• В диафизе длинной трубчатой кости, когда процесс ещё не вышел за пределы кости, выявляют разрежение костной ткани, которое придаёт кости «испещрённый» вид. Часто наблюдают расширение костномозгового канала и разволокнение коркового слоя. Реакция надкостницы выражена в виде линейного или слоистого периостоза, в результате чего тень диафиза кости может быть веретенообразно расширена. По мере прогрессирования процесса периостальная новообразованная кость разрушается, и опухоль прорастает мягкие ткани. При этом у своих полюсов опухоль, продолжая распространяться под надкостницей и отслаивая её, вызывает периостальную аппозицию кости, рентгенологически проявляющуюся в виде козырька.
• При поражении метафизарных отделов кости основной рентгенологический симптом разрушения кости - мелкоочаговая деструкция. Чаще, чем при диафизарной локализации, встречается периостальная реакция в виде козырька.
• Надкостница тазовых костей неплотная, поэтому опухоль быстро выходит за пределы кости, и часто отсутствуют признаки периостального костеобразования. Разрушение кости обычно проявляется в виде мелкоочаговой деструкции. Постоянный диагностический признак саркомы Юинга данной локализации - наличие внекостного мягкотканого компонента без известковых включений, благодаря которому хорошо видны контуры гребня и тела подвздошной кости в виде серповидной тени.
Саркома Юинга стоит несколько обособленно в ряду костных сарком из-за высокой чувствительности к лучевым и лекарственным воздействиям. Основной метод лечения - лучевая терапия суммарной дозой 50-60 Гр. Облучению подлежит вся кость, в которой выявлен очаг поражения. У детей из-за опасности полной остановки роста кости не облучают противоположный эпифиз. Положительное действие лучевого лечения проявляется уже на 1-й неделе: снижается выраженность болевого синдрома, улучшается общее состояние больных, уменьшается мягкотканный компонент опухоли. Первые признаки заживления кости выявляют уже на 3-4-й нед от начала лечения. Однако регрессия опухоли под действием облучения не предупреждает дальнейшего метастазирования и не свидетельствует о благоприятном прогнозе заболевания. Пятилетняя выживаемость после лучевого лечения составляет 10%.
Химиотерапию проводят с целью подавления роста субклинических метастазов. Применение сарколизина в сочетании с цикло- фосфамидом или доксорубицином в комбинации с винкристином приводит к увеличению пятилетней выживаемости по сравнению с чисто лучевым лечением на 4,7 и 40,8% соответственно.
Хирургическое вмешательство необходимо приблизительно у 20% больных: при рецидивах после лучевой терапии, у маленьких детей с поражением эпифизарной зоны кости (ампутация с последующим протезированием более выгодна, чем резко отстающая в росте конечность), а также при большой опухоли и патологическом переломе, когда нет надежды на консолидацию. Следует удалять всю кость во избежание раннего рецидива опухоли.
По окончании лечения лёгкие и поражённую конечность обследуют один раз в 3 мес на протяжении первых 3 лет, а затем - один раз в 4-5 мес ещё 2 года.
Наиболее эффективен следующий вариант лечения. Сначала проводят внутриартериальную химиотерапию доксорубицином или препаратами платины, затем - лучевую терапию на область опухоли в дозе 45-55 Гр. После этого назначают 6-8 курсов внутривенной химиотерапии доксорубицином, винкристином или циклофосфамидон. При данном методе лечения пятилетняя безметастатическая выживаемость достигает 68,3% (данные РОНЦ РАМН).